本試験は実施中であり、1回目の中間解析(中間解析1:試験概要、安全性及び有効性の結果は2023年6月15日、薬物動態、薬力学及び免疫原性の結果は2023年4月14日をデータカットオフ日とした解析)に基づいて記載しています。
ARGX-113-1902/ADHERE+試験(国際共同第Ⅱ相継続投与試験)
「禁忌を含む注意事項等情報」等は電子添文をご参照ください。
試験概要
目的
成人CIDP患者に対するヒフデュラ®の長期安全性、忍容性及び有効性を評価する
試験デザイン
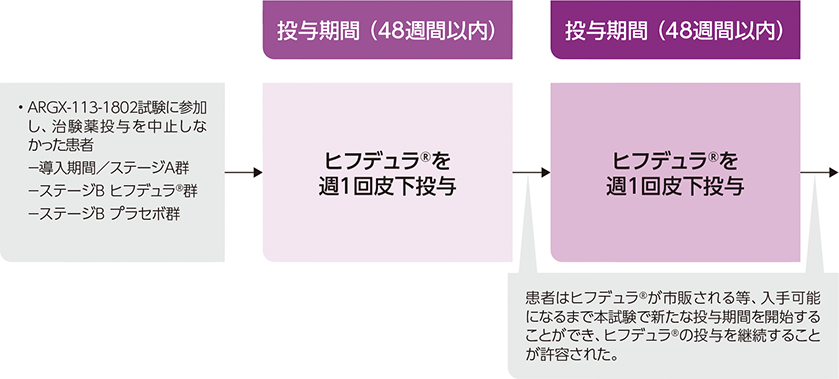
第Ⅱ相、ARGX-113-1802の継続投与、長期、単群、非盲検、多施設共同(日本を含む22か国の125施設)
対象
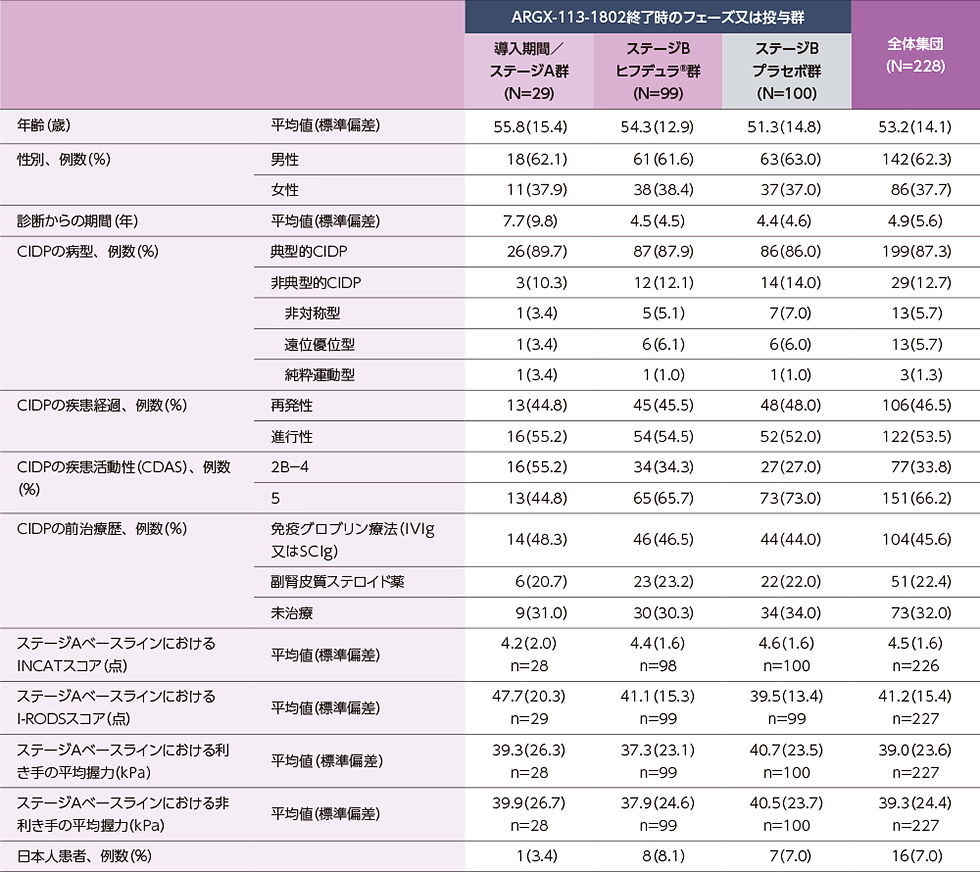
ARGX-113-1802に参加したCIDP患者228例※1(日本人16例)
(ARGX-113-1802終了時のフェーズ又は投与群 導入期間/ステージA群※2:29例、ステージB ヒフデュラ®群:99例、ステージB プラセボ群:100例)
※1 ARGX-113-1802からARGX-113-1902への移行が可能な228例のうち、226例(99.1%)が移行した。その他2例が併用薬に関するプロトコル逸脱があったが移行した。
※2 導入期間又はステージA実施中にARGX-113-1802が終了しARGX-113-1902に移行した群
主な選択基準
ARGX-113-1802に参加し、治験薬投与を中止しなかった成人CIDP患者は、本試験に移行可能とした
投与方法
ヒフデュラ®注)を週1回皮下投与した*。
任意参加のサブスタディでは、本試験で週1回投与を24週間以上完了し、12週間以上臨床状態が安定している患者には、ヒフデュラ®を2週に1回の頻度で投与することができ、また、2週に1回の頻度で24週間以上安定している場合は3週に1回の頻度で投与することができることとした。
*ヒフデュラ®はバイアル製剤を使用した。
注)ARGX-113-1902では2つの製剤が用いられ、エフガルチギモド アルファ(遺伝子組換え)及びボルヒアルロニダーゼ アルファ(遺伝子組換え)として、それぞれ1,006.5mg及び12,200単位又は1,008mg及び11,200単位のいずれかが投与された。
なお、エフガルチギモド アルファ(遺伝子組換え)1,006.5mg及びボルヒアルロニダーゼ アルファ(遺伝子組換え)12,200単位は本邦未承認用量である。
評価項目
【主要評価項目】
- 有害事象及び重篤な有害事象
- 臨床的に重要な臨床検査値異常の発現
【副次評価項目】
- ベースラインからの調整INCATスコアの変化量の推移
- ベースラインからのI-RODSスコアの変化量の推移
- ベースラインからの平均握力の変化量の推移
- ベースラインからのMRC合計スコアの変化量の推移
- ベースラインからのTUGスコアの変化量の推移
- ベースラインからのEQ-5D-5L VASスコアの変化量の推移
- ARGX-113-1802ステージAベースラインからの血清中IgG(総IgG)濃度の変化の推移
- エフガルチギモドに対する抗薬物抗体(ADA)が認められた患者の割合
- エフガルチギモドに対する中和抗体の有無
- 自己投与を行った患者の割合
- 介護者が投与を行った患者の割合
解析方法
主要評価項目及び副次評価項目は記述統計量により要約した。
特定の有害事象として注射部位反応を解析することとした。
患者の内訳
安全性及び有効性のデータカットオフ日までに本試験に228例が登録され、このうち3例(1.3%)が試験完了、29例(12.7%)が試験から脱落、196例(86.0%)が試験実施中でした。また、37例(16.2%)が2回目の48週治療期間、10例(4.4%)が3回目の48週治療期間に該当しました。
患者背景
本試験のベースラインにおける患者背景
安全性評価(2023年6月15日データカットオフ時点)
主要評価項目
有害事象
- 有害事象は全体集団で228例中131例(57.5%)に認められました。
- 主な有害事象(全体集団で5%以上に発現)は、COVID-19が31例(13.6%)、上気道感染が14例(6.1%)でした。
- 重篤な有害事象は、全体集団で21例(CIDPが5例、転倒・挫傷、急性腎障害・尿路感染、肺炎、COVID-19・気管狭窄・創傷感染、COVID-19・無力症・転倒、事故・胸骨骨折・肋骨骨折・外傷性血腫、脳神経障害・痙攣発作、肝機能異常、鼡径ヘルニア、橈骨骨折、COVID-19・血中クレアチンホスホキナーゼ増加・心筋症、下肢骨折、心房細動、リンパ節炎、不安定狭心症、良性前立腺肥大症が各1例)に認められました。
- 投与中止に至った有害事象は、全体集団で9例(CIDPが4例、COVID-19、無力症・眼運動障害、脳神経障害、肝機能異常、リンパ節炎が各1例)に認められました。
- 本試験中に1例(CIDP)の死亡が報告され、治験責任医師によって治験薬との関連が否定できないと判断されました。
有害事象の概要
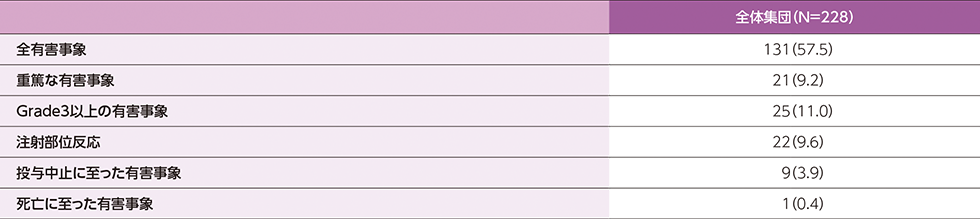
例数(%)
有害事象は、治験薬の初回投与から最終投与の28日後までに発現した有害事象と定義した。
重症度判定にはCTCAE v5.0を使用
主な有害事象(全体集団で5%以上に発現)

例数(%)
有害事象は、治験薬の初回投与から最終投与の28日後までに発現した有害事象と定義した。
MedDRA version 25.1
臨床的に重要な臨床検査値異常の発現
血液生化学的検査、血液学的検査及び尿検査の各パラメータで、ベースラインから臨床的に意味のある変化は認められませんでした。
また、バイタルサイン及び心電図パラメータにベースラインから臨床的に意味のある変化は認められませんでした。
有効性評価(2023年6月15日データカットオフ時点)
副次評価項目
ベースラインからの調整INCATスコアの変化量の推移
ベースラインからの調整INCATスコアの変化量の推移は下図のとおりでした。
ベースラインからの調整INCATスコアの変化量の推移
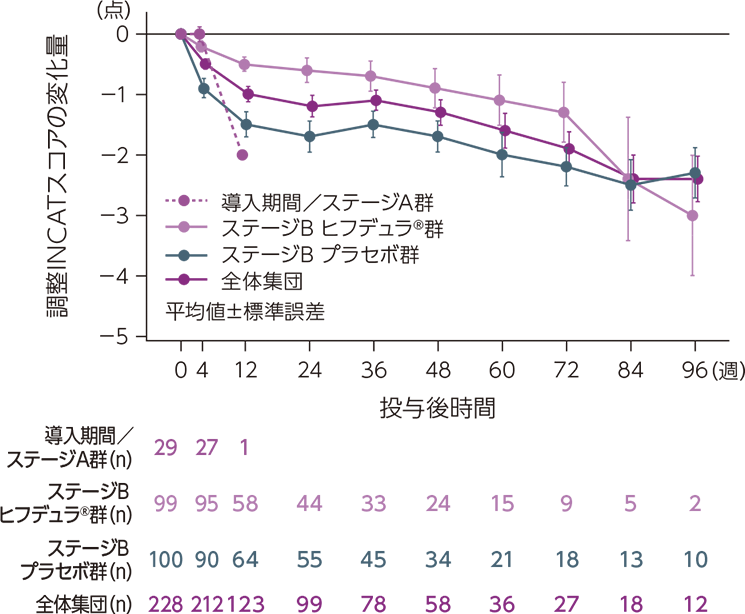
mITT集団
ベースラインからのI-RODSスコアの変化量の推移
ベースラインからのI-RODSスコアの変化量の推移は下図のとおりでした。
ベースラインからのI-RODSスコアの変化量の推移
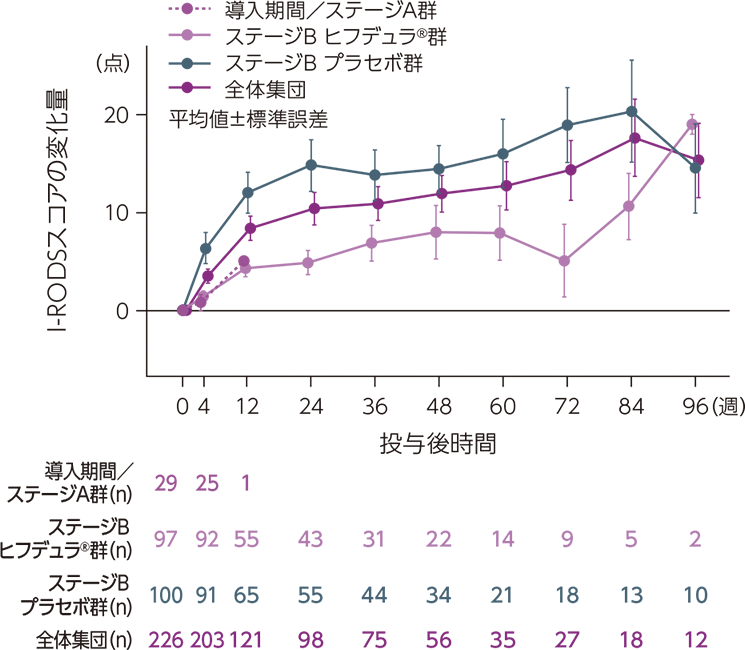
mITT集団
ベースラインからの平均握力の変化量の推移
ベースラインからの利き手及び非利き手の平均握力の変化量の推移は下図のとおりでした。
ベースラインからの利き手の平均握力の変化量の推移
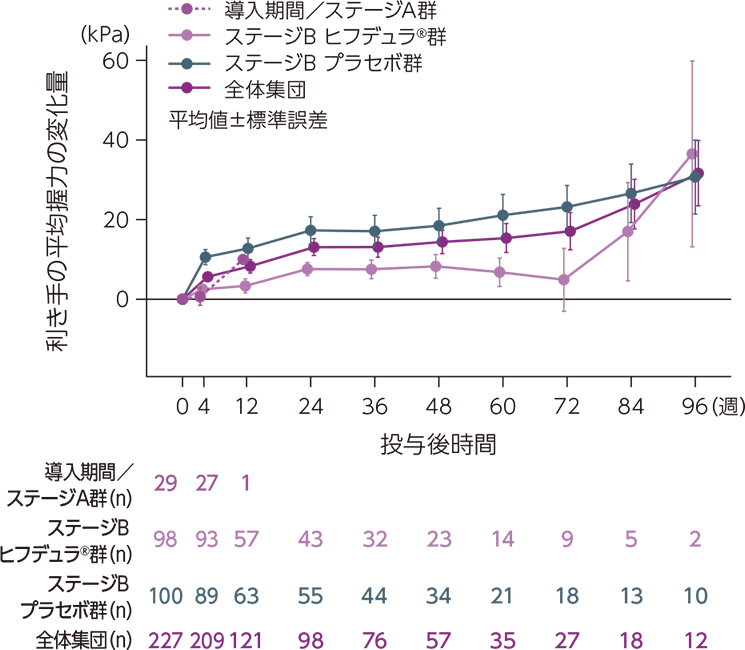
mITT集団
ベースラインからの非利き手の平均握力の変化量の推移
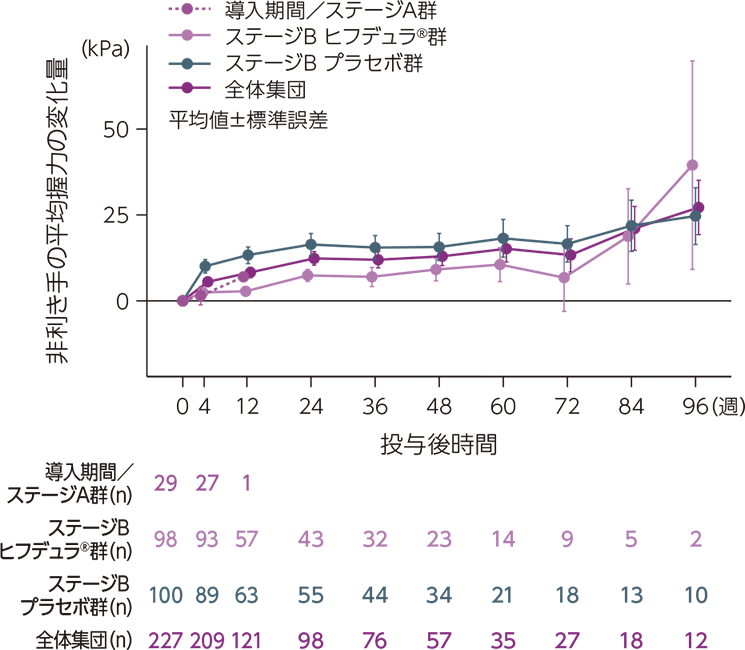
mITT集団
ベースラインからのMRC合計スコアの変化量の推移
全体集団におけるMRC合計スコアのベースラインからの平均変化量(標準誤差)は、12週時で2.8点(0.46)、48週時で3.7点(0.74)でした。
ベースラインからのTUGスコアの変化量の推移
全体集団におけるTUGスコアのベースラインからの平均変化量(標準誤差)は、12週時で-2.8秒(0.53)、48週時で-2.2秒(0.78)でした。
ベースラインからのEQ-5D-5LVASスコアの変化量の推移
全体集団におけるベースラインからのEQ-5D-5L VASスコアの平均変化量(標準誤差)は、12週時で11.0点(1.95)、48週時で14.5点(2.88)でした。
事後解析
本データは事後解析であるが、承認時に評価されたデータであり、CIDP障害スコアの経時的推移を適切に情報提供することを目的として掲載する。
ARGX-113-1802ベースラインからの調整INCATスコアの推移
ARGX-113-1802ベースラインからの調整INCATスコアは以下のような推移を示しました。
ARGX-113-1802ベースラインからの調整INCATスコアの推移
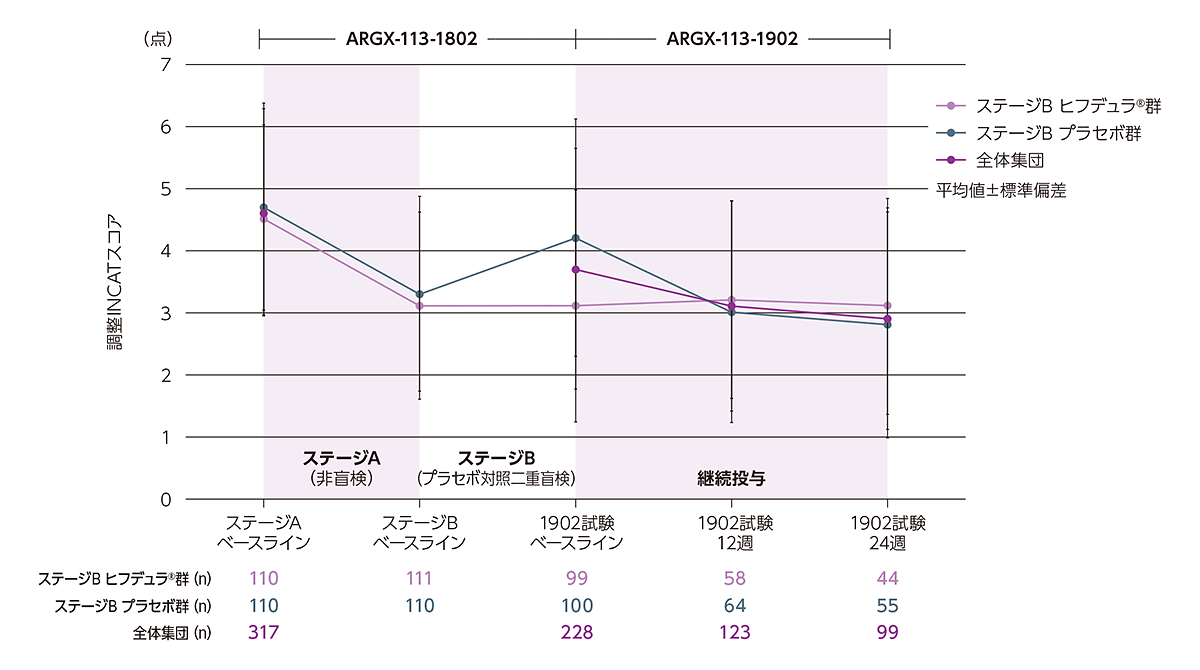
有効性解析対象集団
薬力学的作用(2023年4月14日データカットオフ時点)
副次評価項目
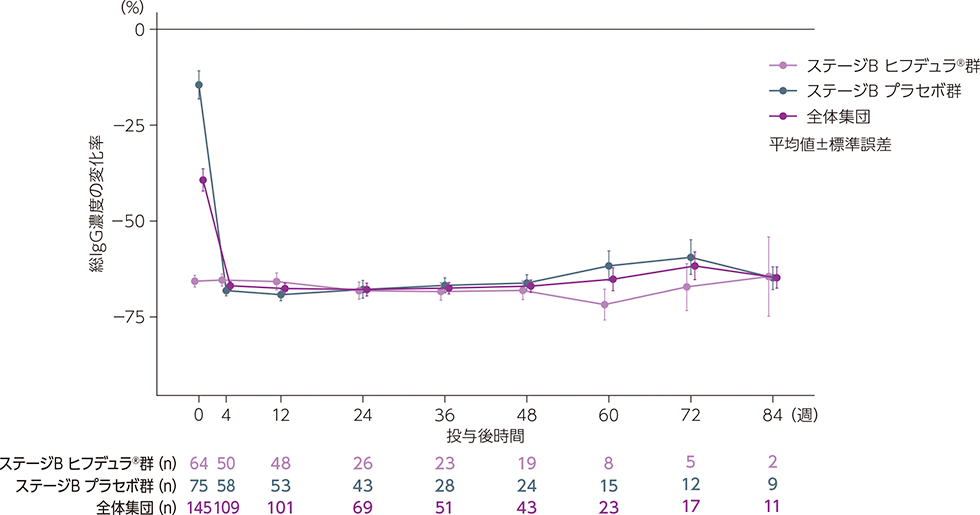
ARGX-113-1802ステージAベースラインからの血清中IgG(総IgG)濃度の変化の推移
ARGX-113-1802ステージAベースラインに対する総IgG濃度の変化率の推移は下図のとおりでした。
ARGX-113-1802ステージAベースラインに対する総IgG濃度の変化率の推移
免疫原性(2023年4月14日データカットオフ時点)
副次評価項目
エフガルチギモドに対する抗薬物抗体(ADA)が認められた患者の割合
エフガルチギモドに対するADAの発現割合は2.6%でした。
エフガルチギモドに対する中和抗体の有無
エフガルチギモドに対する中和抗体は検出されませんでした。
自己投与(2023年6月15日データカットオフ時点)
副次評価項目
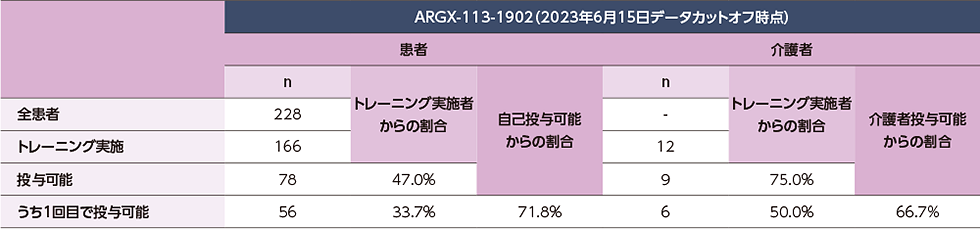
自己投与を行った患者の割合及び介護者が投与を行った患者の割合
ARGX-113-1902において、166例の患者及び12名の介護者が自己投与/介護者投与のトレーニングを受け、そのうちの78例(47.0%)の患者及び9名(75.0%)の介護者がデータカットオフ時点で投与可能と判断されました。また自己投与/介護者投与が可能な患者の71.8%、介護者の66.7%は、1回のトレーニングで投与可能と判断されました。
ARGX-113-1902のデータカットオフ時点でのヒフデュラ®総投与回数のうち、37.1%は自己投与で、6.2%は介護者による投与でした。
トレーニング後、ヒフデュラ®の自己投与が可能と判断された患者及び介護者
治験時は薬液採取には注射針、投与時には翼状針を使用したため、薬事承認後と使用機器が異なる。ヒフデュラ®はバイアル製剤を使用した。
CDAS:CIDP Disease Activity Status
CIDP:chronic inflammatory demyelinating polyradiculoneuropathy:慢性炎症性脱髄性多発根神経炎
EQ-5D-5L:EuroQol 5 dimensions and 5 levels health-related quality-of life questionnaire
INCAT:Inflammatory Neuropathy Cause and Treatment
I-RODS:Inflammatory-Rasch-built Overall Disability Scale
IVIg:intravenous immunoglobulin:経静脈的免疫グロブリン療法
MRC:Medical Research Council
SCIg:subcutaneous immunoglobulin:経皮的免疫グロブリン療法
TUG:timed up and go
VAS:visual analog scale
社内資料:第Ⅱ相試験(ARGX-113-1902試験)(2024年12月承認、CTD2.7.6.2)(EFG90117)
社内資料:1902試験(中間解析1)(2024年12月承認、CTD2.7.3.2.2)(EFG90111)
社内資料:有害事象の解析(2024年12月承認、CTD2.7.4.2.1)(EFG90112)
社内資料:自己投与(2024年12月承認、CTD2.7.4.5.2.2)(EFG90113)
社内資料:CIDP患者での薬力学的作用 - 1902試験(2024年12月承認、CTD2.7.2.2.2.1.2)(EFG90118)
社内資料:免疫原性(2024年12月承認、CTD2.7.2.4.1)(EFG90109)
社内資料:審査報告書(2024年12月承認)
6. 用法及び用量(抜粋) 〈慢性炎症性脱髄性多発根神経炎〉
【ヒフデュラ®配合皮下注】通常、成人には本剤1回5.6mL(エフガルチギモド アルファ(遺伝子組換え)として1,008mg及びボルヒアルロニダーゼ アルファ(遺伝子組換え)として11,200単位)を週1回皮下投与する。
【ヒフデュラ®配合皮下注シリンジ】通常、成人には本剤1回5.0mL(エフガルチギモド アルファ(遺伝子組換え)として1,000mg及びボルヒアルロニダーゼ アルファ(遺伝子組換え)として10,000単位)を週1回皮下投与する。
8. 重要な基本的注意(抜粋)
【ヒフデュラ®配合皮下注】
8.2 本剤の自己投与に際しては、以下の点に注意すること。
・自己投与の適用については、医師がその妥当性を慎重に検討し、十分な教育訓練を実施した後、本剤投与による危険性と対処法について患者が理解し、自ら確実に投与できることを確認した上で、医師の管理指導の下で実施すること。
・使用済みの注射針及び注射器を再使用しないように患者に注意を促し、すべての器具の安全な廃棄方法に関する指導を行うこと。
【ヒフデュラ®配合皮下注シリンジ】
8.2 本剤の自己投与に際しては、以下の点に注意すること。
・本剤の投与開始にあたっては、医療施設において、必ず医師によるか、医師の直接の監督のもとで投与を行うこと。
・自己投与の適用については、医師がその妥当性を慎重に検討し、十分な教育訓練を実施した後、本剤投与による危険性と対処法について患者が理解し、患者自ら確実に投与できることを確認した上で、医師の管理指導の下で実施すること。また、適用後、本剤による副作用が疑われる場合や自己投与の継続が困難な状況となる可能性がある場合には、直ちに自己投与を中止させ、医師の管理下で慎重に観察するなど適切な処置を行うこと。
・使用済みの注射針及び注射器を再使用しないように患者に注意を促し、すべての器具の安全な廃棄方法に関する指導を行うこと。
おすすめコンテンツ
JP-VDJCIDP-25-00752(2025年12月作成)
