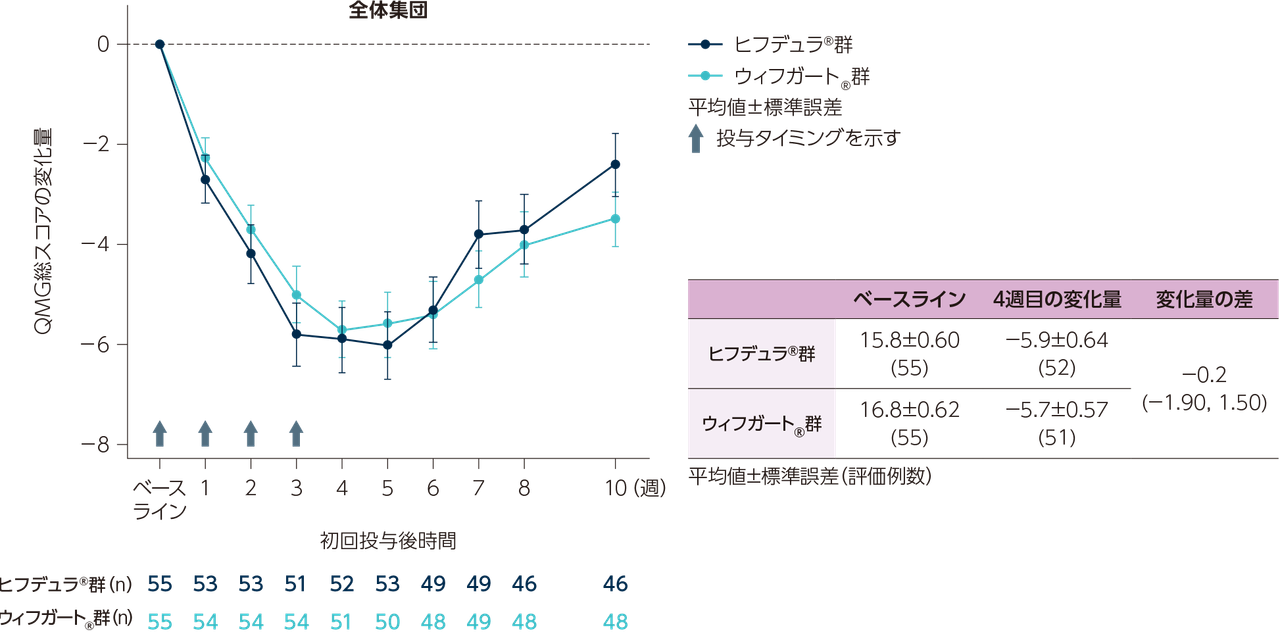
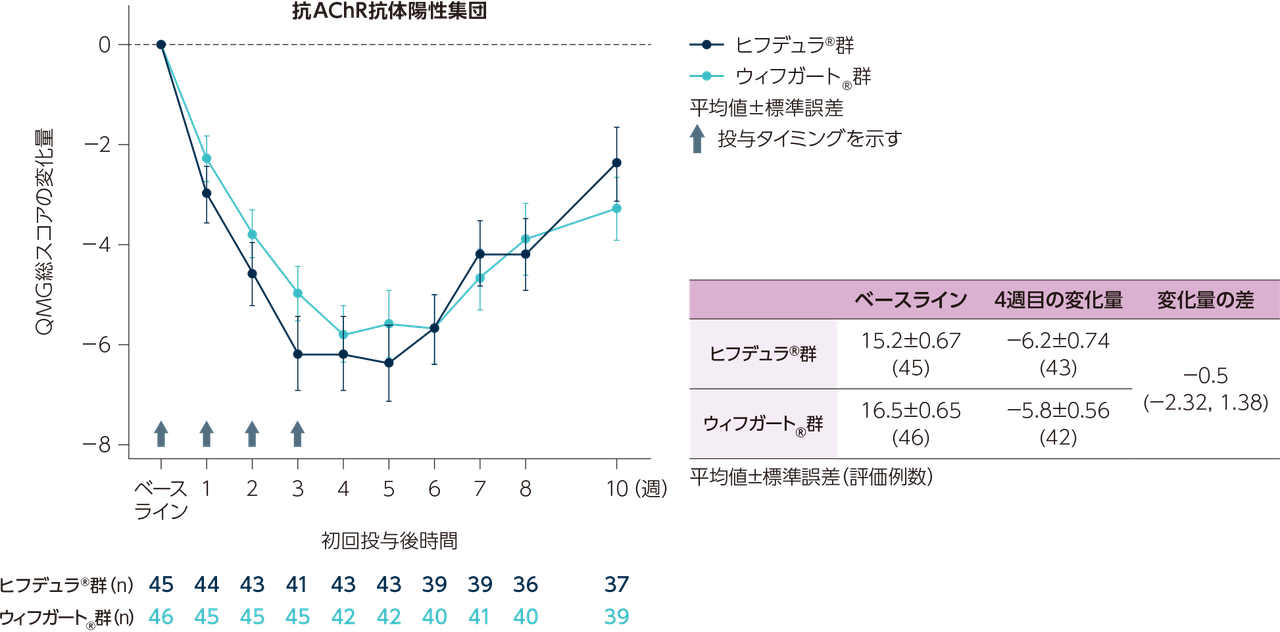
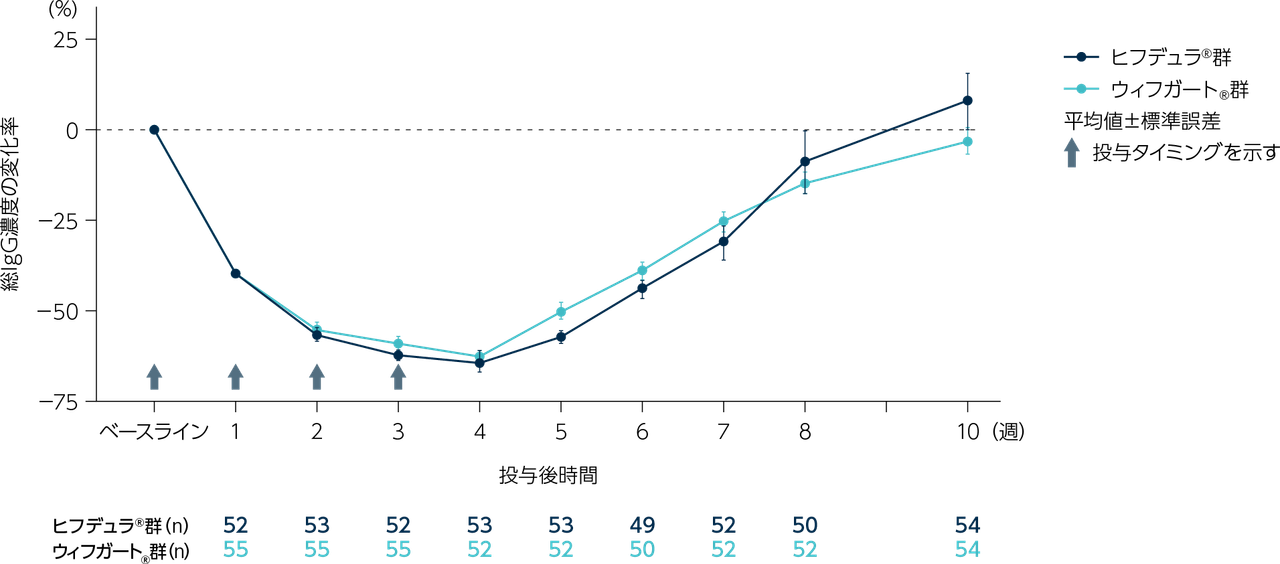
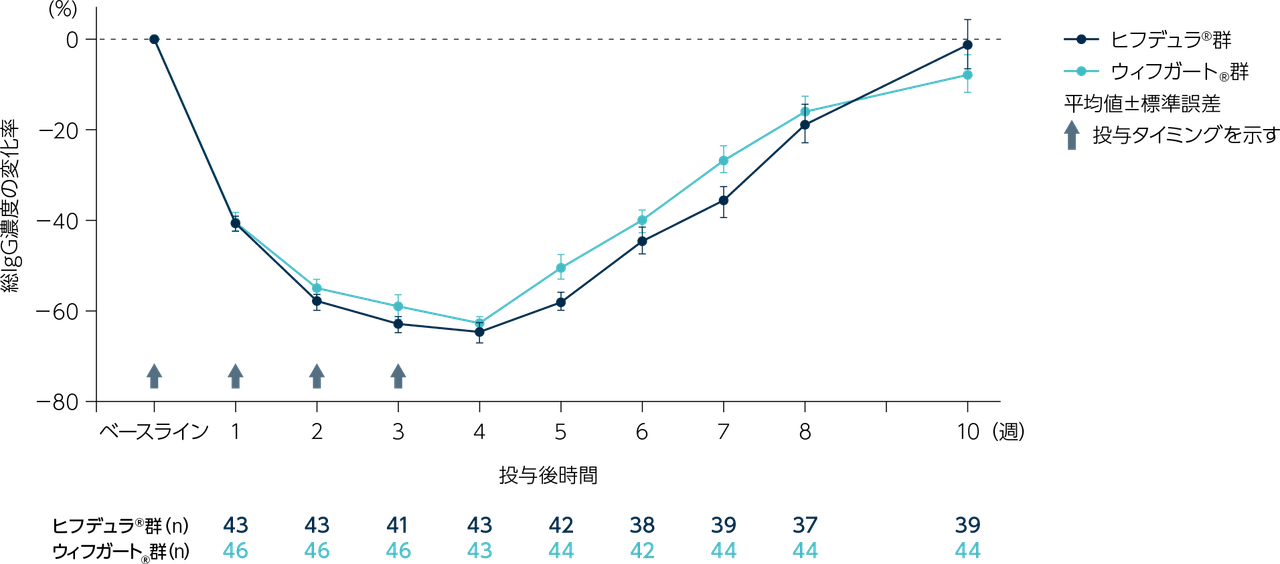
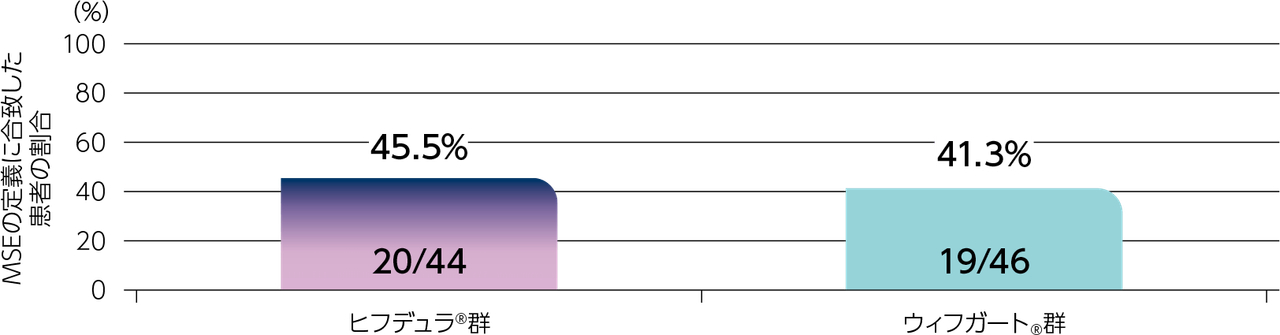目的
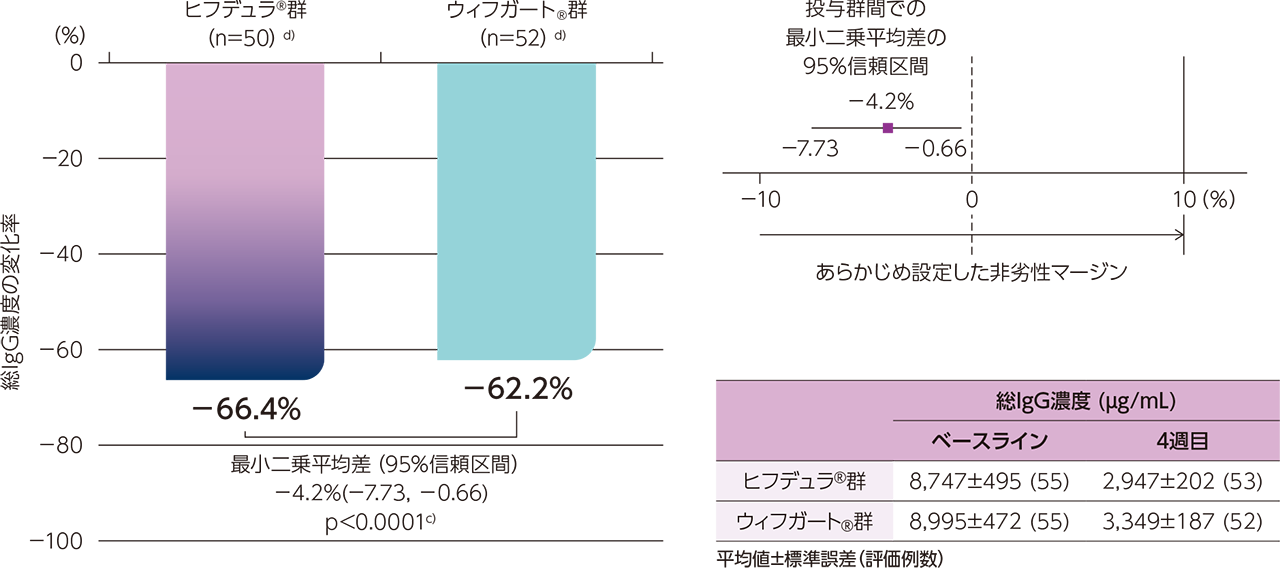
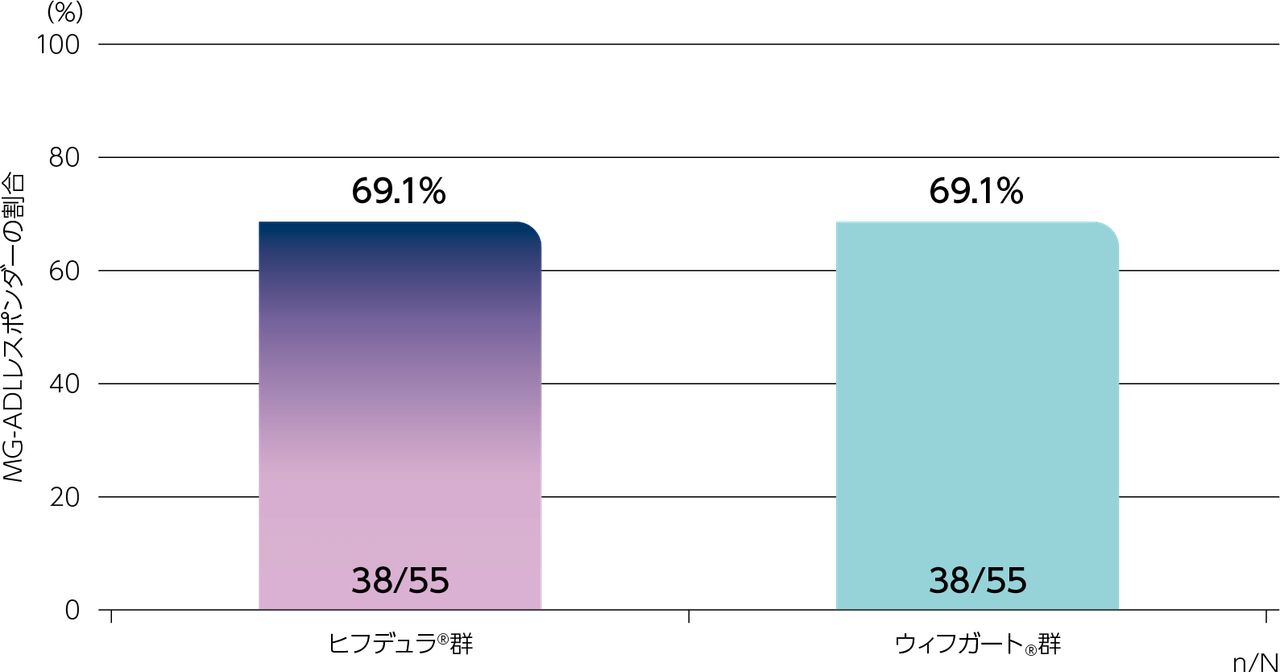
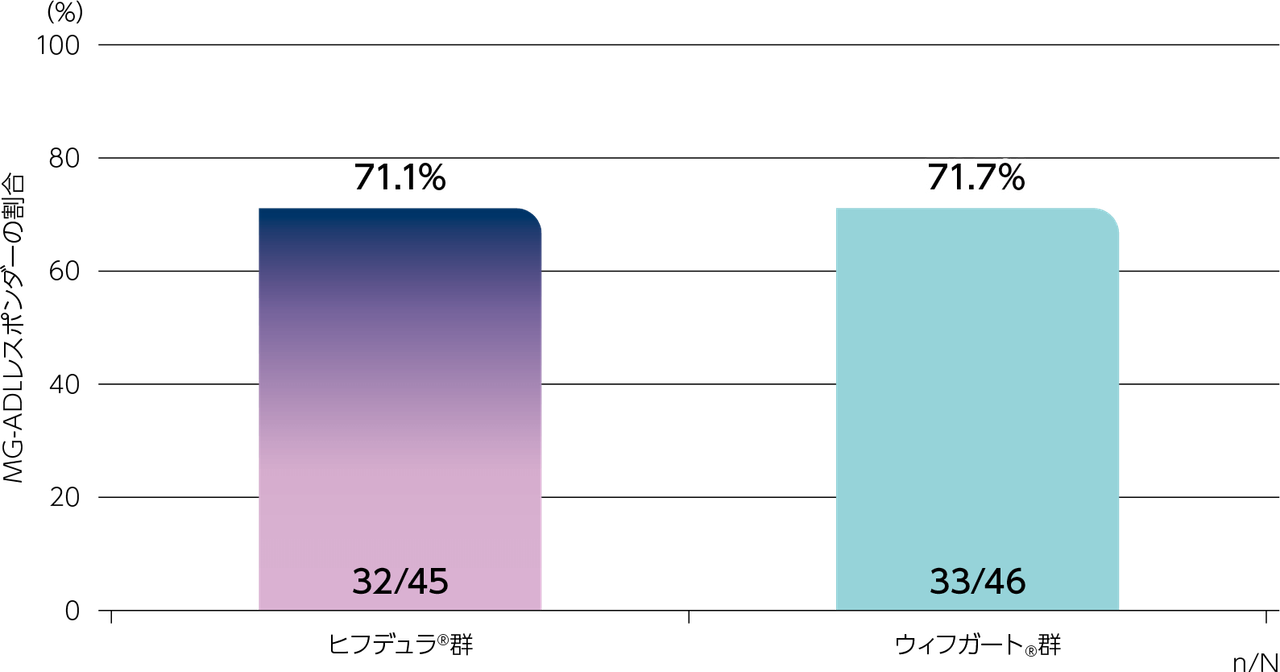
gMG患者に対するヒフデュラ®の薬力学的作用のウィフガート®に対する非劣性を評価する
試験デザイン
ランダム化、非盲検、並行群間比較、多施設共同試験(欧州、米国、ロシア、日本の43施設)
対象
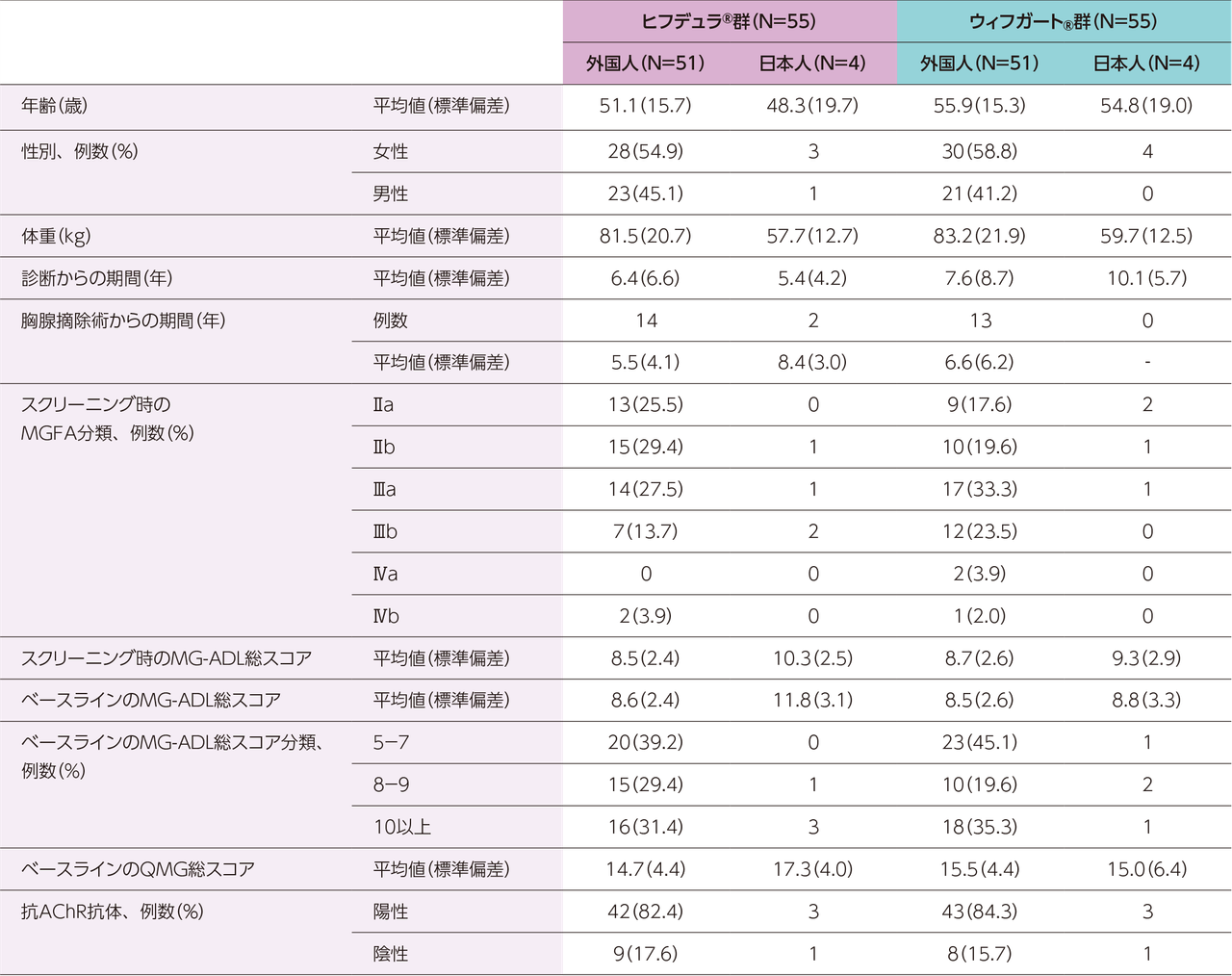
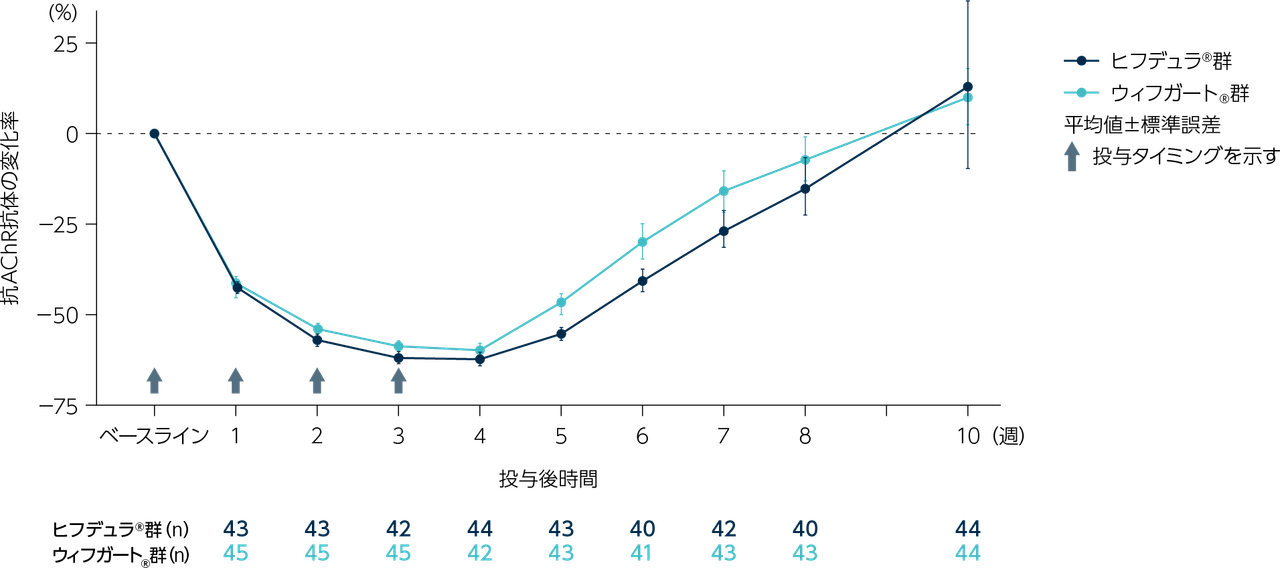
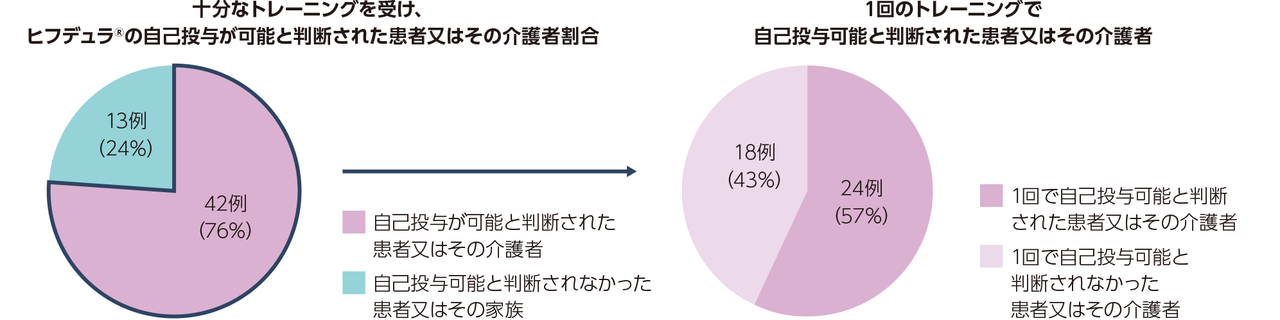
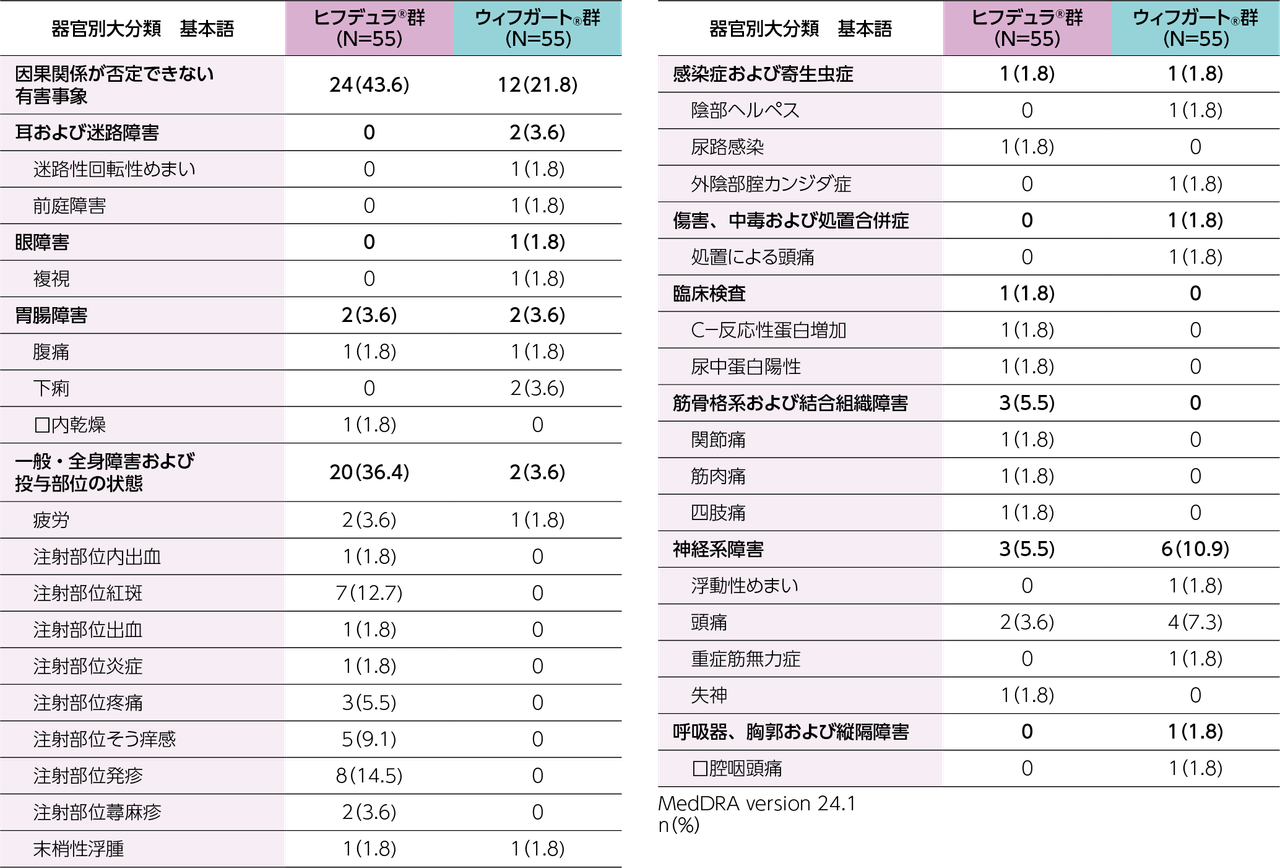
gMG患者111※例(日本人8例)
ヒフデュラ®群:55例(日本人4例)、ウィフガート®群:56例(日本人4例)
※ 計111例の患者を組み入れ、ヒフデュラ®群に55例、ウィフガート®群に56例がランダム化された。安全性解析対象集団(SAF)、ITT集団、及びmITT集団はいずれも110例(各群55例)であった。
主な選択基準
- gMGと診断され、以下のいずれかに該当する患者
- 単線維筋電図検査又は反復神経刺激試験により、神経筋伝達異常が過去に確認された
- 塩化エドロホニウム試験陽性が過去に確認された
- 経口コリンエステラーゼ阻害薬投与後のMG徴候の改善が、主治医の評価で認められた
- スクリーニング及びベースラインでのMG-ADL総スコアが5点以上であり、眼症状以外の項目でのスコアが50%を超えている患者
- gMG治療薬(コリンエステラーゼ阻害薬、経口副腎皮質ステロイド及び/又は非ステロイド性免疫抑制剤)を一定の用量で使用している患者