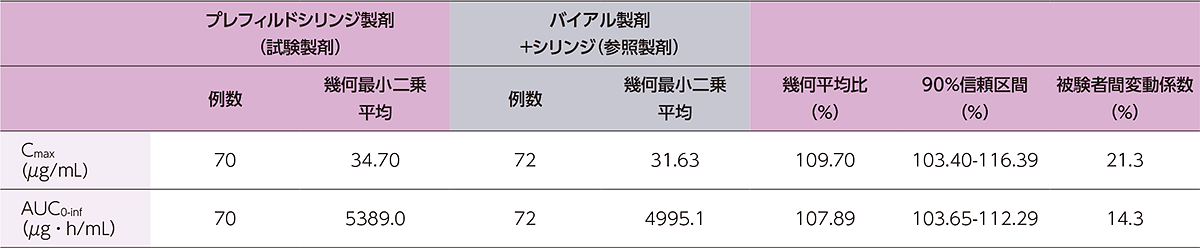
健康成人にヒフデュラ®をプレフィルドシリンジ製剤又はバイアル製剤+シリンジで単回皮下投与したときのCmaxの幾何平均比(90%信頼区間)は109.70%(103.40-116.39)、AUC0-infの幾何平均比(90%信頼区間)は107.89%(103.65-112.29)であり、Cmax及びAUC0-infの幾何平均比の90%信頼区間が事前に設定した許容域である80.00~125.00%の範囲内であったことから、両製剤の生物学的同等性が示されました。
ヒフデュラ®配合皮下注シリンジの薬物動態
単回投与(健康成人;外国人データ)【ARGX-113-2312(生物学的同等性試験)】
健康成人にヒフデュラ®をプレフィルドシリンジ製剤又はバイアル製剤+シリンジで単回皮下投与したときの薬物動態パラメータの統計学的比較解析の要約
薬物動態解析対象集団
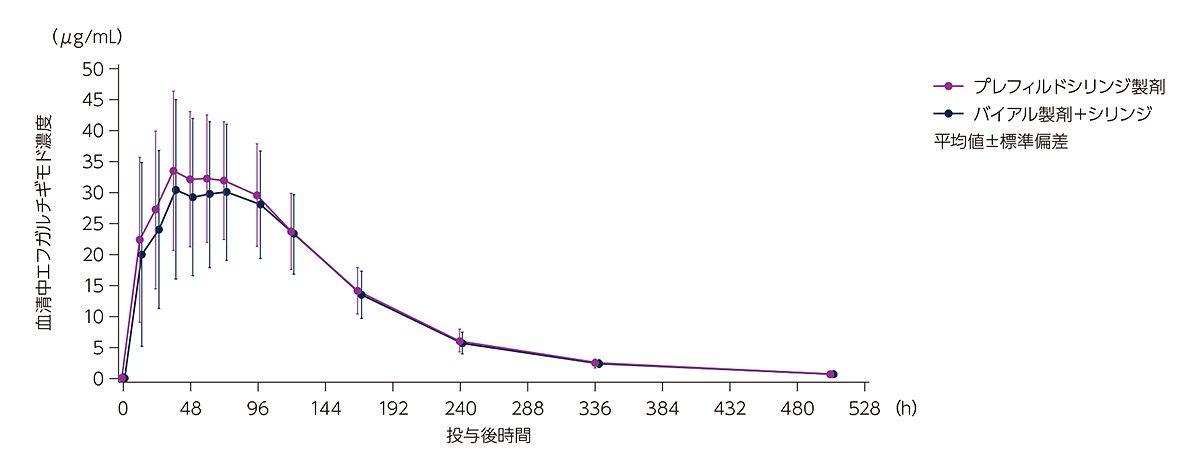
健康成人にヒフデュラ®をプレフィルドシリンジ製剤又はバイアル製剤+シリンジで単回皮下投与したときの平均血清中エフガルチギモド濃度推移は下図のとおりでした。
健康成人にヒフデュラ®をプレフィルドシリンジ製剤又はバイアル製剤+シリンジで単回皮下投与したときの平均血清中エフガルチギモド濃度推移
薬物動態解析対象集団
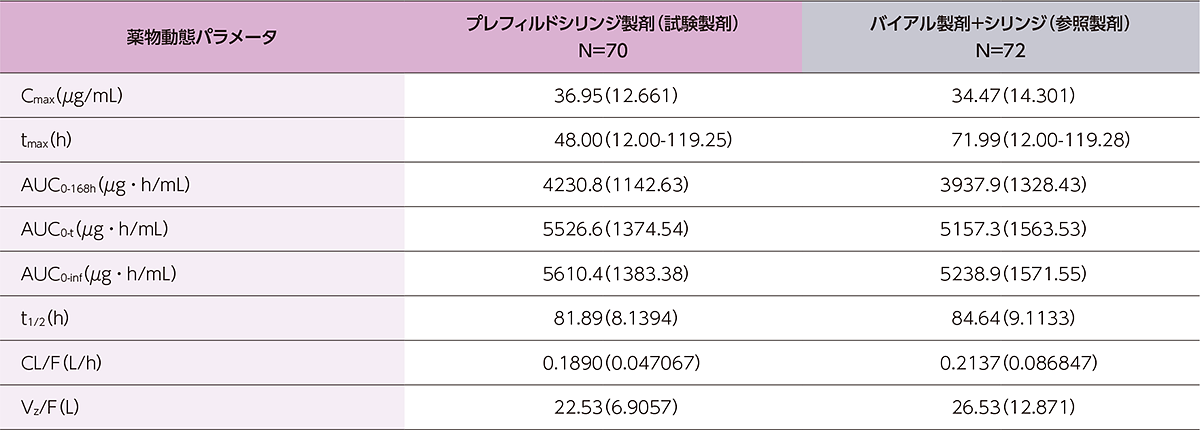
薬物動態パラメータの詳細は下表のとおりでした。
健康成人にヒフデュラ®をプレフィルドシリンジ製剤又はバイアル製剤+シリンジで単回皮下投与したときの薬物動態パラメータの要約
薬物動態解析対象集団
値は、tmaxは中央値(最小値-最大値)、他は算術平均(標準偏差)で表示。
Cmax:最高血清中濃度、tmax:最高血清中濃度到達時間、AUC0-t:時間0から最終濃度測定可能時間までのAUC、AUC0-inf:時間0から無限時間までのAUC、t1/2:(見かけの)半減期、CL( /F):(見かけの)全身クリアランス、Vz( /F):(見かけの)分布容積
参考:安全性情報
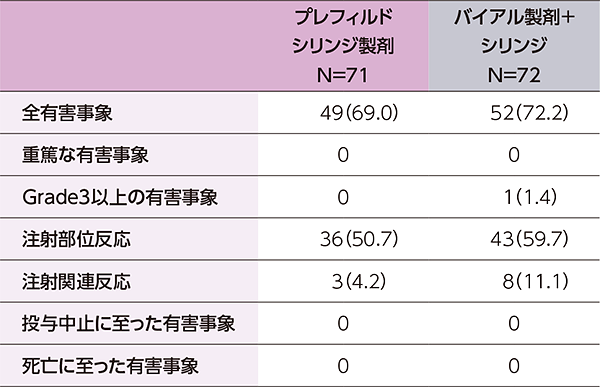
- 有害事象はプレフィルドシリンジ製剤で71例中49例(69.0%)、バイアル製剤+シリンジで72例中52例(72.2%)に認められました。
- 主な有害事象(いずれかの製剤で5%以上に発現)は、下表のとおりでした。
- 本試験において、重篤な有害事象、投与中止に至った有害事象、死亡は認められませんでした。
有害事象の概要
例数(%)
主な有害事象(いずれかの製剤で5%以上に発現)
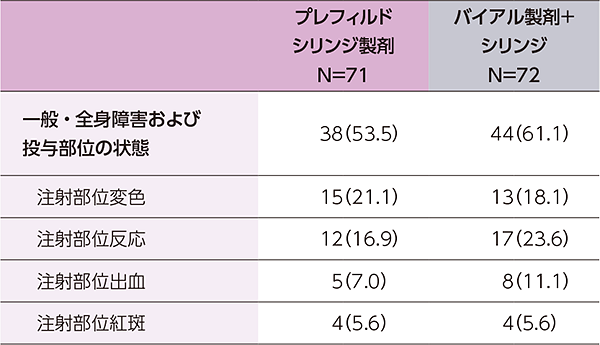
例数(%)
MedDRA Version 26.1
社内資料:ARGX-113-2312試験(2025年9月承認) (EFG90125)
4. 効能又は効果
〇全身型重症筋無力症(ステロイド剤又はステロイド剤以外の免疫抑制剤が十分に奏効しない場合に限る)
〇慢性炎症性脱髄性多発根神経炎
6. 用法及び用量
〈全身型重症筋無力症〉
【ヒフデュラ®配合皮下注】通常、成人には本剤1回5.6mL(エフガルチギモド アルファ(遺伝子組換え)として1,008mg及びボルヒアルロニダーゼ アルファ(遺伝子組換え)として11,200単位)を1週間間隔で4回皮下投与する。これを1サイクルとして、投与を繰り返す。
【ヒフデュラ®配合皮下注シリンジ】通常、成人には本剤1回5.0mL(エフガルチギモド アルファ(遺伝子組換え)として1,000mg及びボルヒアルロニダーゼ アルファ(遺伝子組換え)として10,000単位)を1週間間隔で4回皮下投与する。これを1サイクルとして、投与を繰り返す。
〈慢性炎症性脱髄性多発根神経炎〉
【ヒフデュラ®配合皮下注】通常、成人には本剤1回5.6mL(エフガルチギモド アルファ(遺伝子組換え)として1,008mg及びボルヒアルロニダーゼ アルファ(遺伝子組換え)として11,200単位)を週1回皮下投与する。
【ヒフデュラ®配合皮下注シリンジ】通常、成人には本剤1回5.0mL(エフガルチギモド アルファ(遺伝子組換え)として1,000mg及びボルヒアルロニダーゼ アルファ(遺伝子組換え)として10,000単位)を週1回皮下投与する。
おすすめコンテンツ
JP-VDJCIDP-25-00752(2025年12月作成)
